Fluorescentie.
Fluorescentie is een verschijnsel
dat je allemaal wel kent. Je hebt vast wel eens oplichtende sterren
op het plafond van je kamer geplakt. Of je hebt ooit wel eens iets van
zogenaamd coldlight gezien op
een camping of een feest.
Ook vuurvliegjes kun je zien dank zij fluorescentie
Ook op bankbiljetten en postzegels
wordt vaak gebruik gemaakt van fluorescentie. Om namaak
te voorkomen wordt met fluorescerende inkt een afdruk gemaakt op het biljet of
de postzegel.
Meer informatie over fosforescentie en fluorescentie
Sommige materialen hebben merkwaardige eigenschappen. Ze kunnen
verschillende soorten energie absorberen en opslaan en een deel van deze
energie achteraf weer uitzenden onder de vorm van licht. Dit proces houdt twee
stappen in:
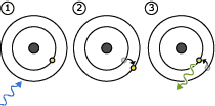
1/ De energie die eerst wordt geabsorbeerd zorgt ervoor dat de elektronen van
de atomen van het absorberend materiaal geëxciteerd worden. Dat wil zeggen dat
de elektronen (die in banen rond de kern van het atoom draaien) van een meer
inwendig naar een meer uitwendig gelegen baan springen.
2/ Wanneer de elektronen terug naar hun oorspronkelijke toestand terugvallen,
wordt een pakketje licht uitgezonden.
De tijd die tussen deze twee stappen verloopt kan ofwel heel kort (minder dan
1/100.000 van een seconde) ofwel lang (verschillende uren) zijn.
Bij
een kort interval spreken we van fluorescentie. Een alledaags voorbeeld van
fluorescentie vinden we in de beeldbuis van onze televisie. Die is bedekt met
fluorescerende materialen die oplichten wanneer ze geëxciteerd worden door de
kathodestraalbuis.
Bij
een lang interval spreken we van fosforescentie. Het bekendste voorbeeld hier
is wellicht de wijzerplaat van een horloge die 's nachts oplicht. De
kleurstofmoleculen worden geëxciteerd door het daglicht. Daarna stralen ze
slechts heel langzaam hun fosforescentielicht uit. Overdag is dit nauwelijks
zichtbaar omdat het omgevingslicht veel sterker is. 's Nachts echter, wanneer
onze ogen gewend zijn aan het duister, kunnen we het zwakke fosforescentielicht
waarnemen.
We
kunnen fosforescentie nog wat meer in detail gaan bekijken.
Fosforescentie in detail
Een atoom of een molecule bezit een beperkt aantal energetische
toestanden, elk met hun eigen energie. De toestand met de laagste energie
noemen we de grondtoestand. Dit is de toestand waarin een atoom of molecule
zich bevindt vooraleer het een of andere vorm van energie heeft geabsorbeerd.
Wanneer het nu bv. licht absorbeert komt het in een hogere energietoestand
terecht, een aangeslagen toestand.
Licht
bestaat uit afzonderlijke lichtpakketjes of fotonen. Elk van deze fotonen bezit
een energie die gelijk is het product van een vaste waarde, de constante van
Planck (h = 6,6E-34 Js) en de frequentie van het licht.
We schrijven de energie van het invallend foton dan als hv(in).
Absorptie van fotonen is enkel mogelijk wanneer de ingestraalde energie hv(in)
gelijk is aan het energieverschil van de grondtoestand en van de aangeslagen
toestand, Eaan-Egrond.
Nadat
het atoom in een aangeslagen toestand terecht is gekomen, zijn er verschillende
opties. Het atoom kan naar zijn grondtoestand terugkeren door hetzelfde foton
uit te zenden. Dit is fluorescentie. Vooraleer fluorescentie plaatsvindt, kan
er een overgang zijn tussen twee aangeslagen toestanden.
Fosforescentie treedt op wanneer het atoom naar een andere toestand overgaat
waarbij bv. de spin (het intrinsiek draaimoment van het elektron, vergelijkbaar
met het draaimoment van een spinnende tol) van één van de elektronen verandert.
In de kwantummechanica wordt dan gesproken van een verboden overgang omdat het
een overgang is die zeer weinig voorkomt. Uiteindelijk keert ook hier het atoom
terug naar de grondtoestand met de uitzending van een foton.